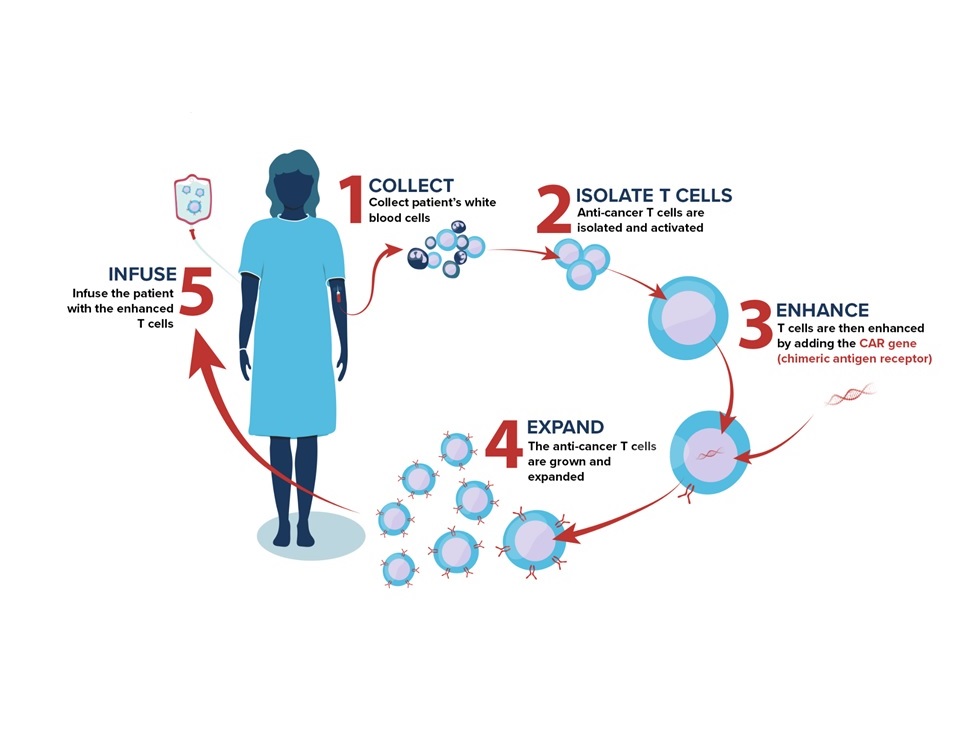
Liệu pháp tế bào thụ thể kháng nguyên khảm trên tế bào T (Chimeric Antigen Receptor T-cell – CAR-T) là một phương pháp điều trị miễn dịch mang tính cách mạng, thuộc nhóm liệu pháp chuyển tế bào nuôi, trong đó các tế bào lympho T của chính bệnh nhân được biến đổi di truyền để biểu hiện một thụ thể tổng hợp. Thụ thể này, được gọi là CAR, cho phép các tế bào T đã được tái lập trình có khả năng nhận diện và tiêu diệt các tế bào ung thư một cách đặc hiệu. Do khả năng tồn tại, nhân lên và thực hiện chức năng giám sát miễn dịch lâu dài trong cơ thể bệnh nhân, các tế bào CAR-T thường được gọi là “thuốc sống” (living drugs), đánh dấu một sự thay đổi mô hình cơ bản trong dược lý học và điều trị ung thư.
Hệ miễn dịch của con người, đặc biệt là các tế bào T, có khả năng tự nhiên trong việc xác định và loại bỏ các tế bào bất thường, bao gồm cả tế bào ung thư. Tuy nhiên, các khối u ác tính thường phát triển các cơ chế phức tạp để trốn tránh sự giám sát miễn dịch này. Chúng có thể làm giảm biểu hiện các kháng nguyên bề mặt, tạo ra một môi trường vi mô ức chế miễn dịch, hoặc kích hoạt các điểm kiểm soát miễn dịch để làm bất hoạt các tế bào T tấn công. Liệu pháp CAR-T được thiết kế để vượt qua những rào cản này. Bằng cách trang bị cho tế bào T một thụ thể CAR, liệu pháp này cung cấp một cơ chế nhận diện kháng nguyên mới, mạnh mẽ và không phụ thuộc vào Phức hợp Hòa hợp Mô chính (Major Histocompatibility Complex – MHC). Điều này cho phép các tế bào CAR-T “nhìn thấy” và tấn công các tế bào ung thư ngay cả khi chúng đã mất khả năng trình diện kháng nguyên thông thường, một cơ chế trốn thoát miễn dịch phổ biến. Về bản chất, liệu pháp CAR-T “huấn luyện lại” hệ miễn dịch của bệnh nhân để chống lại kẻ thù mà trước đây nó không thể nhận ra.
Sự ra đời của liệu pháp CAR-T đã tạo ra một bước ngoặt trong điều trị các bệnh lý huyết học ác tính, đặc biệt đối với những bệnh nhân bị bệnh tái phát hoặc kháng trị (R/R) sau khi đã thất bại với các phương pháp điều trị tiêu chuẩn như hóa trị liệu, xạ trị và ghép tế bào gốc tạo máu. Việc Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt các liệu pháp CAR-T đầu tiên vào năm 2017 – Tisagenlecleucel (Kymriah)1 cho bệnh bạch cầu cấp dòng lympho B (B-ALL) ở trẻ em và thanh niên, và Axicabtagene ciloleucel (Yescarta) cho u lympho tế bào B lớn lan tỏa (DLBCL) ở người lớn – đã chính thức mở ra một kỷ nguyên mới trong y học chính xác và liệu pháp miễn dịch tế bào. Những thành công ban đầu này không chỉ mang lại hy vọng cho những bệnh nhân không còn lựa chọn điều trị mà còn xúc tác cho một làn sóng nghiên cứu và phát triển sâu rộng, mở rộng tiềm năng của CAR-T sang các loại ung thư khác và thậm chí cả các bệnh không phải ung thư.
Một trong những khía cạnh sâu sắc nhất của công nghệ CAR-T là nó không chỉ là một phương pháp điều trị ung thư mà còn là một nền tảng trị liệu linh hoạt. Cơ chế cốt lõi—loại bỏ tế bào một cách đặc hiệu dựa trên kháng nguyên—có thể được áp dụng cho các bối cảnh bệnh lý khác nhau. Ví dụ, trong điều trị ung thư hạch, tác dụng phụ “trúng mục tiêu, ngoài khối u” (on-target, off-tumor) là tình trạng bất sản tế bào B (B-cell aplasia) do CAR-T tiêu diệt cả tế bào B ác tính và khỏe mạnh có biểu hiện CD19. Tình trạng này được xem là một độc tính có thể kiểm soát được. Tuy nhiên, trong bối cảnh các bệnh tự miễn như lupus ban đỏ hệ thống, chính việc loại bỏ các tế bào B tự phản ứng này lại là mục tiêu điều trị mong muốn.2 Sự đối ngẫu này cho thấy tiềm năng của CAR-T là một công nghệ nền tảng có thể được điều chỉnh để điều trị một loạt các bệnh lý qua trung gian tế bào, vượt xa khỏi phạm vi ung thư học ban đầu.
Dưới đây là các thử nghiệm lâm sàng liên quan đến liệu pháp CAR-T
Bảng 3: Tóm tắt các Liệu pháp CAR-T được Phê duyệt và các Thử nghiệm Lâm sàng (Dữ liệu 2020-2025)
| Tên thương mại (Hoạt chất) | Mục tiêu/Miền đồng kích thích | Chỉ định chính | Thử nghiệm Then chốt | ORR (%) | CR (%) | mOS (tháng) | mPFS (tháng) |
| Kymriah (tisa-cel)1 | CD19 / 4-1BB | B-ALL (trẻ em/thanh niên) | ELIANA | 82 | 60 | 55% tại 5 năm | 43.8 |
| DLBCL R/R | JULIET | 53 | 39 | 11.1 | 2.9 | ||
| Yescarta (axi-cel)3 | CD19 / CD28 | LBCL R/R (≥2 dòng) | ZUMA-1, ZUMA-7 | 74-83 | 54-65 | 25.8 (ZUMA-1) | 5.9 (ZUMA-1) |
| iNHL R/R | ZUMA-5 | 94 (FL) | 80 (FL) | Chưa đạt | 40.2 (FL) | ||
| Tecartus (brexu-cel)4 | CD19 / CD28 | MCL R/R | ZUMA-2 | 91 | 68 | 46.6 | 28.2 (DOR) |
| B-ALL R/R (người lớn) | ZUMA-3 | 71 (CR/CRi) | 56 | 26.0 | 11.6 (RFS) | ||
| Breyanzi (liso-cel)5 | CD19 / 4-1BB | LBCL R/R (≥2 dòng) | TRANSFORM | 86 | 68 | Chưa đạt | 10.1 |
| FL/MZL R/R | TRANSCEND FL | 95.5 (MZL) | 62.1 (MZL) | 90.4% tại 2 năm | 85.7% tại 2 năm | ||
| Abecma (ide-cel)6 | BCMA / 4-1BB | MM R/R (≥2 dòng) | KarMMa, KarMMa-3 | 73 (KarMMa) | 33 (KarMMa) | 19.4 (KarMMa) | 8.8 (KarMMa) |
| Carvykti (cilta-cel)7 | BCMA / 4-1BB | MM R/R (≥1 dòng) | CARTITUDE-1, 4 | 98 (C-1) | 83 (C-1) | 60.7 (C-1) | 34.9 (C-1) |
Lưu ý: Dữ liệu được tổng hợp từ các báo cáo theo dõi dài hạn khác nhau và có thể thay đổi tùy thuộc vào thời điểm cắt dữ liệu và quần thể bệnh nhân cụ thể. ORR: Tỷ lệ đáp ứng toàn bộ; CR: Tỷ lệ đáp ứng hoàn toàn; mOS: Thời gian sống còn toàn bộ trung vị; mPFS: Thời gian sống còn không tiến triển trung vị; DOR: Thời gian đáp ứng; RFS: Thời gian sống còn không tái phát.
Mặc dù có các kết quả tích cực, nhưng liệu pháp CAR-T vẫn còn một số rào cản:
- Lựa chọn Kháng nguyên và Tính không Đồng nhất: Việc tìm kiếm các kháng nguyên đặc hiệu cho khối u và được biểu hiện đồng nhất trên tất cả các tế bào ung thư là cực kỳ khó khăn. Nhiều kháng nguyên tiềm năng là các kháng nguyên liên quan đến khối u (Tumor-Associated Antigens – TAA), cũng được biểu hiện ở mức độ thấp trên các mô khỏe mạnh, làm tăng nguy cơ độc tính “trúng mục tiêu, ngoài khối u” nghiêm trọng. Ngoài ra, các khối u đặc thường là một tập hợp không đồng nhất của các dòng tế bào, một số có thể không biểu hiện kháng nguyên mục tiêu, tạo điều kiện cho sự trốn thoát miễn dịch.
- Sự Di chuyển và Xâm nhập của CAR-T: Không giống như các tế bào ung thư máu dễ tiếp cận trong tuần hoàn, các khối u đặc được bảo vệ bởi các rào cản vật lý. Các tế bào CAR-T phải thoát ra khỏi mạch máu, di chuyển qua một lớp mô đệm dày đặc (stroma) và một mạng lưới mạch máu bất thường để đến được lõi khối u.
- Môi trường Vi mô Khối u Ức chế Miễn dịch (TME): TME của các khối u đặc là một môi trường khắc nghiệt, thiếu oxy, nghèo dinh dưỡng và chứa đầy các tế bào ức chế miễn dịch (như tế bào T điều hòa – Tregs, tế bào ức chế nguồn gốc tủy – MDSCs) và các phân tử ức chế (như PD-L1, TGF-β). Môi trường này làm cho các tế bào CAR-T nhanh chóng bị mất chức năng.
Mặc dù vậy, tương lai của liệu pháp CAR-T rất tươi sáng và đầy hứa hẹn. Lĩnh vực này đang phát triển với tốc độ nhanh chóng, được thúc đẩy bởi sự hội tụ của các công nghệ tiên tiến. Việc tích hợp kỹ thuật di truyền chính xác như CRISPR/Cas9, các hệ thống phân phối mới như hạt nano lipid, và các mô hình sản xuất sáng tạo như liệu pháp dị thân “sẵn có” và sản xuất phân cấp, hứa hẹn sẽ khắc phục nhiều hạn chế hiện tại. Việc mở rộng ứng dụng sang các khối u đặc và các bệnh không ác tính như bệnh tự miễn cho thấy sự tiến hóa của CAR-T từ một phương pháp điều trị ung thư chuyên biệt thành một nền tảng trị liệu rộng lớn. Khi công nghệ tiếp tục trưởng thành, liệu pháp CAR-T có tiềm năng trở nên an toàn hơn, hiệu quả hơn và dễ tiếp cận hơn, tiếp tục định nghĩa lại các giới hạn của y học và thay đổi cuộc sống của bệnh nhân trên toàn thế giới.
——-
Tài liệu tham khảo
- Liu Y, Chen X, Han W, Zhang Y. Tisagenlecleucel, an approved anti-CD19 chimeric antigen receptor T-cell therapy for the treatment of leukemia. Drugs Today (Barc). 2017 Nov;53(11):597-608. doi: 10.1358/dot.2017.53.11.2725754. PMID: 29451276.
- Wu Y, Han L, Wang Y, Gu M, Wang Y, Gao J, Huang H, Li C. CAR-T therapy: pioneering a new era in the treatment of autoimmune diseases. Front Immunol. 2025 Aug 13;16:1625166. doi: 10.3389/fimmu.2025.1625166. PMID: 40881712; PMCID: PMC12380546.
- Chartier M, Filosto S, Peyret T, Chiney M, Milletti F, Budka J, Ndi A, Dong J, Vardhanabhuti S, Mao D, Duffull S, Dodds M, Shen R. Investigating the Influence of Covariates on Axicabtagene Ciloleucel (axi-cel) Kinetics in Patients with Non-Hodgkin’s Lymphoma. Clin Pharmacokinet. 2024 Sep;63(9):1283-1299. doi: 10.1007/s40262-024-01413-z. Epub 2024 Sep 6. PMID: 39240498.
- Brexucabtagene Autoleucel (Tecartus): CADTH Reimbursement Review: Therapeutic area: Acute lymphoblastic leukemia [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2023 Jun. Clinical Review. Available from: https://www.ncbi.nlm.nih.gov/books/NBK595344/
- Lisocabtagene Maraleucel (Breyanzi): CADTH Reimbursement Recommendation: Indication: For the treatment of adult patients with relapsed or refractory large B-cell lymphoma after 2 or more lines of systemic therapy, including diffuse large B-cell lymphoma (DLBCL) not otherwise specified, primary mediastinal large B-cell lymphoma, high-grade B-cell lymphoma, and DLBCL arising from follicular lymphoma [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2022 Jul. Available from: https://www.ncbi.nlm.nih.gov/books/NBK603593/
- Hansen DK, Sidana S, Peres LC, Colin Leitzinger C, Shune L, Shrewsbury A, Gonzalez R, Sborov DW, Wagner C, Dima D, Hashmi H, Kocoglu MH, Atrash S, Simmons G, Kalariya N, Ferreri C, Afrough A, Kansagra A, Voorhees P, Baz R, Khouri J, Alsina M, McGuirk J, Locke FL, Patel KK. Idecabtagene Vicleucel for Relapsed/Refractory Multiple Myeloma: Real-World Experience From the Myeloma CAR T Consortium. J Clin Oncol. 2023 Apr 10;41(11):2087-2097. doi: 10.1200/JCO.22.01365. Epub 2023 Jan 9. PMID: 36623248; PMCID: PMC10082273.
- Ciltacabtagene Autoleucel (Carvykti): Indication: For the treatment of adult patients with multiple myeloma, who have received 1 to 3 prior lines of therapy, including a proteasome inhibitor and an immunomodulatory agent, and who are refractory to lenalidomide: Reimbursement Recommendation [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2024 Nov. Available from: https://www.ncbi.nlm.nih.gov/books/NBK610233/


Leave a Reply