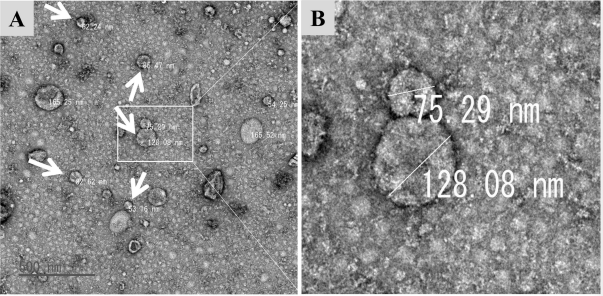
Các nhà khoa học tại Trường Đại học Y Stanford vừa công bố một tiến bộ khoa học được đánh giá là có thể thay đổi tương lai điều trị đái tháo đường type 1. Lần đầu tiên, họ đã ngăn ngừa và đảo ngược hoàn toàn bệnh trên mô hình chuột mà không cần sử dụng thuốc ức chế miễn dịch lâu dài. Thành tựu này đến từ một chiến lược táo bạo: kết hợp ghép tế bào gốc tạo máu với ghép đảo tụy từ cùng một người hiến, qua đó tái lập trình hệ miễn dịch để ngừng tấn công tế bào beta – căn nguyên của bệnh.
Đái tháo đường type 1 là một rối loạn tự miễn, trong đó hệ miễn dịch nhầm lẫn các tế bào beta sản xuất insulin là “kẻ xâm nhập” và tiêu diệt chúng một cách có hệ thống. Khi lượng tế bào beta bị phá hủy quá nhiều, người bệnh mất khả năng tự sản xuất insulin và phải dựa vào tiêm insulin suốt đời. Rủi ro hạ đường huyết, tổn thương tim mạch, thận, thần kinh và võng mạc kéo dài luôn hiện hữu trong hành trình điều trị. Trong nhiều thập kỷ, khoa học vẫn chưa tìm được cách ngăn chặn vòng xoáy tự miễn này, bởi mọi nỗ lực ghép đảo tụy đều bị chặn lại bởi chính hệ miễn dịch quá nhạy của bệnh nhân hoặc yêu cầu bắt buộc phải dùng thuốc ức chế miễn dịch mạnh với nhiều tác dụng phụ nguy hiểm.
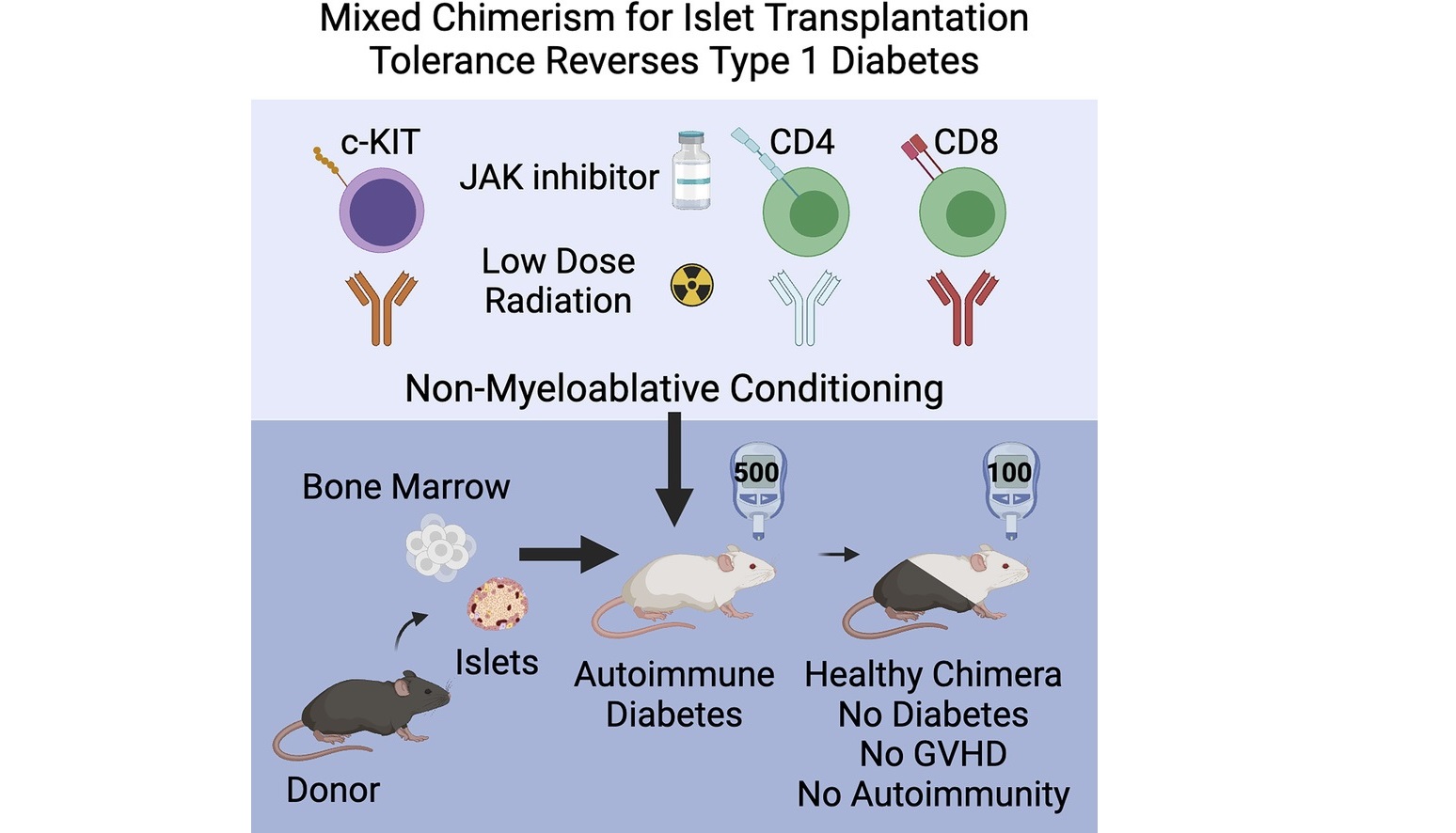
Chiến lược mà nhóm Stanford xây dựng mở ra một hướng tiếp cận mang tính “cài đặt lại” toàn bộ hệ miễn dịch. Thay vì ghép đảo tụy đơn lẻ như các phương pháp truyền thống, họ đồng thời ghép tế bào gốc tạo máu từ người hiến và các đảo tụy của chính người hiến đó. Sự kết hợp này tạo nên một trạng thái miễn dịch hỗn hợp – hay còn gọi là “miễn dịch lai”. Trong trạng thái này, tế bào miễn dịch mới phát sinh từ tế bào gốc của người hiến cùng tồn tại với hệ miễn dịch của vật chủ, và cả hai học cách chấp nhận nhau như “một cơ thể duy nhất”. Chính nhờ đó, đảo tụy ghép không bị tấn công, đồng thời cơ chế tự miễn phá hủy tế bào beta cũng được ngăn chặn.
Điểm quan trọng giúp phương pháp này khả thi là phác đồ “tiền điều kiện” rất nhẹ nhàng trước ghép. Thay vì sử dụng hóa trị hoặc xạ trị liều cao như trong ghép tủy cổ điển, các nhà nghiên cứu chỉ dùng chiếu xạ liều thấp kết hợp với các kháng thể nhắm trúng đích để dọn đường chọn lọc cho tế bào gốc mới. Phác đồ này đủ mạnh để tạo chỗ cho hệ miễn dịch lai hình thành nhưng đủ dịu để hạn chế độc tính, một yếu tố quan trọng nếu muốn chuyển giao chiến lược này sang điều trị bệnh tự miễn ở người.
Kết quả đạt được trên mô hình chuột khiến cộng đồng khoa học đặc biệt chú ý. Ở nhóm chuột mới bắt đầu biểu hiện nguy cơ tiền đái tháo đường, 19 trên 19 con duy trì đường huyết hoàn toàn bình thường sau điều trị, không phát triển bệnh trong suốt sáu tháng theo dõi. Ở nhóm chuột đã mắc đái tháo đường type 1 từ trước, toàn bộ số chuột được điều trị đều hồi phục hoàn toàn khả năng kiểm soát đường huyết mà không cần sử dụng thêm insulin. Đáng chú ý hơn, hiện tượng thải ghép hoặc bệnh ghép chống chủ – biến chứng vốn là nỗi lo thường trực của ghép tế bào gốc – hoàn toàn không xuất hiện.
Thành tựu này không phải là bước đi đơn lẻ mà kế thừa trực tiếp từ nhiều năm phát triển khoa học tại Stanford. Trước đây, nhóm nghiên cứu đã chứng minh rằng ghép tủy xương bán tương hợp kèm ghép thận từ cùng người hiến có thể giúp bệnh nhân duy trì thận ghép trong nhiều năm mà không cần dùng ức chế miễn dịch dài hạn. Lần này, họ mở rộng khái niệm ấy sang bệnh tự miễn, với một phác đồ tinh chỉnh phù hợp hơn với những người không mắc bệnh lý ác tính.
Dẫu vậy, khoa học vẫn còn nhiều câu hỏi cần lời giải trước khi phương pháp này có thể ứng dụng ở người. Nguồn đảo tụy từ người hiến là vô cùng hạn chế, và việc yêu cầu cả đảo tụy lẫn tế bào gốc tạo máu đến từ cùng một người hiến khiến nguồn cung càng thêm khan hiếm. Độ an toàn lâu dài cũng cần được kiểm chứng qua các thử nghiệm lâm sàng nhiều năm, đặc biệt ở những bệnh nhân trẻ tuổi. Dù vậy, các nhà khoa học đang hướng đến giải pháp sản xuất đảo tụy từ tế bào gốc vạn năng trong phòng thí nghiệm, một bước tiến có thể giải quyết triệt để vấn đề nguồn cung trong tương lai.
Ý nghĩa của công trình này vượt xa phạm vi đái tháo đường type 1. Nếu nguyên tắc tạo miễn dịch lai an toàn và bền vững có thể áp dụng trên người, hàng loạt bệnh tự miễn – từ lupus, viêm khớp dạng thấp đến thiếu máu hồng cầu hình liềm – có thể bước vào kỷ nguyên điều trị mới, nơi mục tiêu không chỉ là kiểm soát triệu chứng mà là tái lập trình lại hệ miễn dịch ở cấp độ căn bản.
Dù hiện tại còn quá sớm để nói rằng chúng ta đã tìm thấy “phương pháp chữa khỏi” cho bệnh nhân đái tháo đường type 1, nghiên cứu của Stanford mang đến một tín hiệu lạc quan: bệnh tự miễn có thể không phải là sự trừng phạt suốt đời. Bằng cách kết hợp công nghệ tế bào gốc, ghép mô và điều hòa miễn dịch chính xác, ngành y học đang tiến gần hơn bao giờ hết đến một tương lai nơi cơ thể có thể được “đặt lại” để tự chữa lành từ gốc rễ.