Báo cáo nghiên cứu mới đăng trên Acta Neuropathologica Communications (2025) chỉ ra “cửa sổ vàng” sau hóa trị temozolomide, khi miễn dịch bẩm sinh có thể triệt tiêu hoàn toàn tế bào gốc u não còn sót lại.
Bối cảnh
Glioblastoma (GBM) – U nguyên bào thần kinh đệm ác tính (HGG) – là một trong những bệnh ung thư có tiên lượng xấu nhất, với thời gian sống trung vị hiếm khi vượt quá 15 tháng dù đã phẫu thuật, xạ trị và hóa trị temozolomide (TMZ). Hầu hết bệnh nhân đều tái phát do tế bào gốc u thần kinh đệm (glioma stem cells – GSCs) sống sót sau điều trị và khởi phát lại khối u kháng thuốc.
Miễn dịch thích ứng (như T-cell và CAR-T) từng được kỳ vọng là chìa khóa cho GBM, nhưng hiệu quả lâm sàng còn hạn chế do đặc thù của khối u não và hàng rào máu não (BBB) ngăn chặn sự xâm nhập của tế bào miễn dịch. Trong bối cảnh đó, tế bào NK (Natural Killer cells) – thành phần của miễn dịch bẩm sinh, có khả năng nhận biết và tiêu diệt các tế bào “bất thường” mà không cần kháng nguyên đặc hiệu – đang được xem là hướng tiếp cận mới đầy tiềm năng.
Thiết kế nghiên cứu: kết hợp hóa trị và liệu pháp NK trong mô hình chuột mang tế bào gốc u người
Nhóm nghiên cứu do GS. Janusz Rak (Đại học McGill, Canada) dẫn đầu đã triển khai một loạt thí nghiệm tiền lâm sàng để xác định thời điểm và điều kiện mà NK có thể đạt hiệu quả tối đa trong kiểm soát GBM.
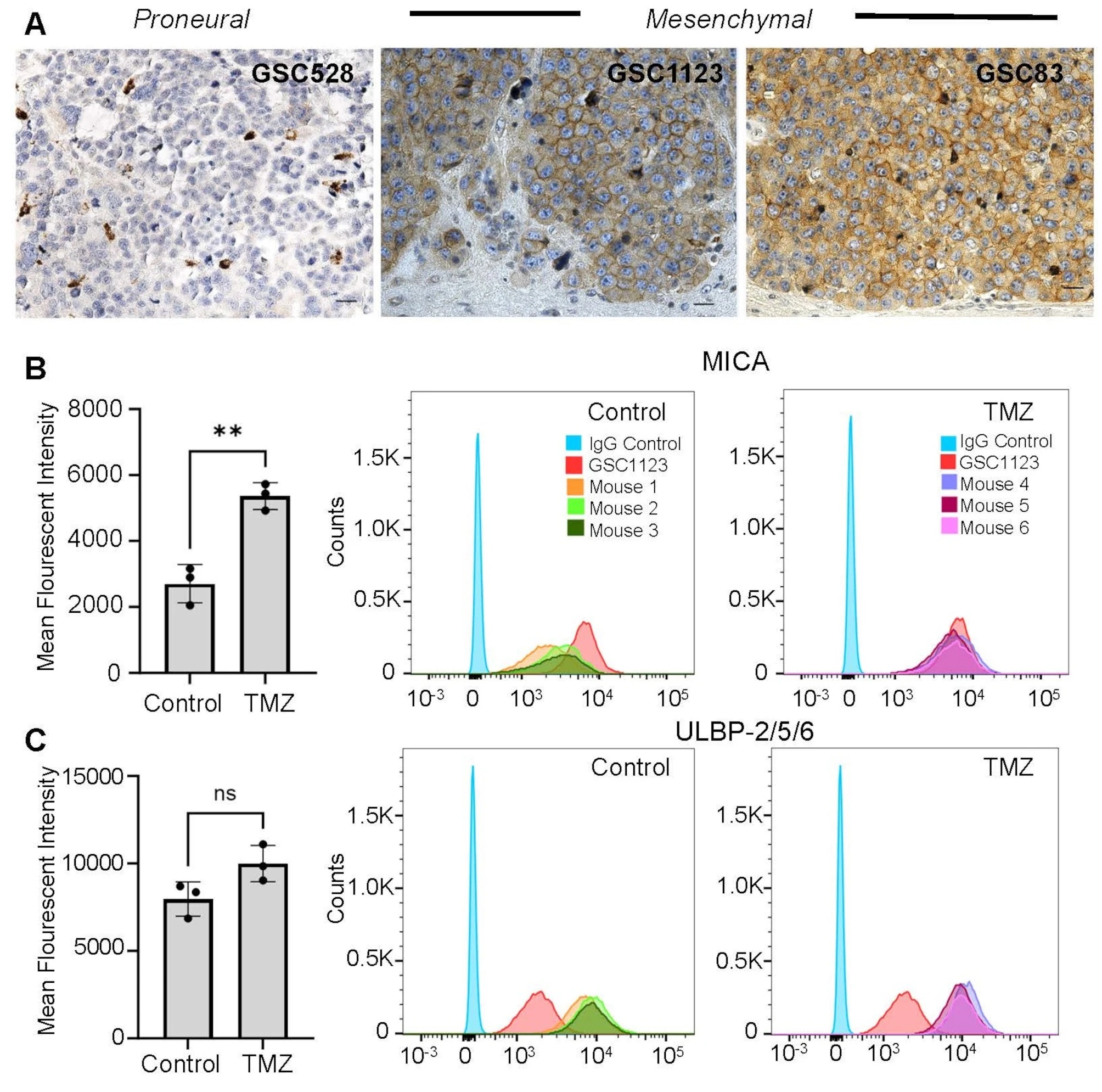
Các tác giả sử dụng hai nhóm tế bào gốc u người đại diện cho hai kiểu hình chính: mesenchymal (MES-GSC; GSC1123, GSC83) và proneural (PN-GSC; GSC528, GSC84, GSC157). Các dòng này được cấy vào chuột SCID (có NK nội sinh) và NSG (thiếu NK). Khối u được điều trị bằng TMZ 120–200 mg/kg i.p., sau đó nhóm nghiên cứu tiêm tế bào NK92MI – một dòng NK người được FDA chấp thuận cho thử nghiệm lâm sàng – trực tiếp vào não (intracranial injection) ở những thời điểm khác nhau sau hóa trị.
Để đảm bảo an toàn sinh học, một số NK92MI được chiếu xạ liều 5 Gy nhằm loại bỏ khả năng tăng sinh, tạo ra dòng NK92MI-IR vẫn duy trì hoạt tính gây độc nhưng không có nguy cơ hình thành khối u thứ phát.
Kết quả
Phân tích phiên mã và dòng chảy tế bào cho thấy MES-GSC biểu hiện mạnh các ligand hoạt hóa NK như MICA, ULBP2/5/6 và PVR/CD155, trong khi PN-GSC hầu như không biểu hiện. Đáng chú ý, TMZ không làm thay đổi đáng kể mức biểu hiện các ligand này, cho thấy tính nhạy cảm của MES-GSC là đặc trưng nội tại chứ không phụ thuộc hóa trị.
Trong thử nghiệm gây độc tế bào (bioluminescence cytotoxicity assay), NK92MI tiêu diệt mạnh MES-GSC ở nhiều tỷ lệ effector:target (p < 0,0001), nhưng hoàn toàn không ảnh hưởng đến PN-GSC. Kết quả này xác lập sự khác biệt sinh học căn bản giữa hai kiểu hình GSC trong đáp ứng với miễn dịch bẩm sinh.
NK nội sinh quyết định khả năng “chữa khỏi” sau TMZ ở mô hình dưới da
Trong mô hình chuột NSG (thiếu NK), TMZ gây thuyên giảm thoáng qua nhưng u tái phát sau 40–50 ngày. Ngược lại, ở chuột SCID (có NK), u MES-GSC bị triệt tiêu hoàn toàn sau TMZ, với chuột sống trên 200 ngày không tái phát, trong khi u PN-GSC vẫn tái phát nhanh chóng.
Khi nhóm nghiên cứu khử NK nội sinh bằng anti-Asialo-GM1, hiệu ứng “chữa khỏi” biến mất hoàn toàn, 7/8 chuột tái phát và tử vong trong vòng 56 ngày. Quan sát mô học cho thấy tế bào NKp46+ xâm nhập mạnh vào khối u ở ngày 3 và 14 sau TMZ, tập trung quanh vùng hoại tử và rìa khối u đang thoái triển – bằng chứng trực tiếp rằng NK là yếu tố then chốt trong quá trình loại bỏ phần còn sót của u MES-GSC.
Tiêm nội sọ NK sau TMZ tái lập kiểm soát u trong não
Trong mô hình nội sọ, TMZ 120–200 mg/kg đơn thuần không đủ để ngăn tái phát vì sự xâm nhập của NK vào nhu mô não bị hạn chế. Tuy nhiên, khi tiêm NK92MI trực tiếp vào não 2 ngày sau TMZ, tất cả chuột mang u MES-GSC (GSC1123) khỏi hoàn toàn và sống trên 150 ngày, trong khi các nhóm chỉ dùng TMZ hoặc NK đơn độc đều thất bại.
Khi sử dụng NK92MI-IR (chiếu xạ 5 Gy), kết quả vẫn được duy trì:
- Mô hình GSC83: 5/5 chuột khỏi bệnh.
- Mô hình GSC1123: 4/6 chuột khỏi bệnh.
Không phát hiện dấu vết tế bào u hay NK người trong mô não sau 7–10 ngày, khẳng định tính an toàn sinh học của phương pháp.
“Thời điểm vàng” 2–7 ngày sau hóa trị là yếu tố sống còn
Hiệu quả của liệu pháp NK phụ thuộc chặt chẽ vào thời điểm tiêm. Khi NK92MI-IR được tiêm 2–7 ngày sau TMZ, 9/12 chuột không có u sau 150 ngày; nhưng nếu trì hoãn 14–21 ngày, chỉ 3/9 chuột duy trì sống không bệnh. Trong thí nghiệm pha loãng (không dùng TMZ), chỉ tỷ lệ 80:1 (NK:đích) mới đủ ức chế sự mọc u, trong khi 10:1 chỉ làm chậm tiến triển.
Những số liệu này chứng minh rằng hiệu quả của NK đạt đỉnh trong khoảng thời gian ngắn sau hóa trị, khi khối u đã bị “làm rỗng” nhưng chưa kịp tái lập, và tỷ lệ effector:target vẫn thuận lợi cho diệt trừ hoàn toàn.
Nghiên cứu xác lập một nguyên lý can thiệp mới: phối hợp hóa trị giảm khối u (TMZ) với liệu pháp NK nội sọ định thời, nhằm tận dụng “cửa sổ vàng” miễn dịch bẩm sinh để xóa bỏ triệt để tế bào gốc u còn sót.
Đặc biệt, việc phân tầng phân tử theo kiểu hình mesenchymal có thể giúp nhận diện nhóm bệnh nhân GBM nhạy cảm với NK, dựa trên biểu hiện cao các ligand MICA, ULBP và CD155. Đồng thời, sử dụng NK92MI-IR chiếu xạ cung cấp một hướng tiếp cận an toàn, khả thi về mặt lâm sàng cho điều trị tại chỗ.
Công trình của nhóm McGill University Health Centre cho thấy, nếu tế bào NK được đưa vào đúng thời điểm (2–7 ngày sau TMZ), chúng có thể chặn hoàn toàn tái phát u não ác tính do tế bào gốc u kiểu hình mesenchymal gây ra.
Phát hiện này mở ra hướng phát triển các phác đồ “miễn-dịch + hóa trị định thời” cho GBM, nhấn mạnh tầm quan trọng của định danh kiểu hình u và thời điểm can thiệp chính xác, hướng tới mục tiêu lâu dài là biến bệnh u não ác tính từ không thể chữa khỏi thành có thể kiểm soát bền vững.
Nguồn: Meehan B., Adnani L., Zhu X., et al. Curative timed NK cell-based immunochemotherapy aborts brain tumour recurrence driven by mesenchymal glioma stem cells. Acta Neuropathologica Communications. 2025; 13:64. https://doi.org/10.1186/s40478-025-01984-3


Leave a Reply